地址:湖北省大冶市罗桥工业园大冶大道284号
电话:0714-8758589
13797788774
13117030666
传真:0714-8758579
邮编:435000
详细内容
工业飞速发展使废水中有机物种类越来越多、 治理难度大、 色度高、 浓度高且难降解,其中染料废水已成为国内外水处理的研究热点[1, 2, 3]. 被称为“环境友好”技术的电化学氧化法(electrochemical oxidation process,EOP)是近年逐渐发展的一种处理难降解有机污染物的水处理技术,可以使污染物在电极上发生直接电化学反应或间接电化学转化,使难降解的有机物在常温常压下分解,达到染料脱色的目的. 但是,电化学氧化法效率低、 能耗大等缺点使得该法不能在工业领域广泛应用[4, 5, 6, 7].
多金属氧酸盐(polyoxometalates,POM)是一类具有确定组成和规则结构的金属氧簇化合物,在均相和非均相体系中,可作为性能优异的酸碱、 氧化还原或双功能催化剂[8]. 因此,为提高间接电化学氧化技术处理效率,采用杂多酸作为催化剂来强化电解过程. 然而POM的比表面积很小(1~10 m2 ·g-1),限制了其催化性能的发挥; 同时,POM在一些极性溶剂中存在着溶解和流失的问题[9,10].
本研究选用比表面积较大、 热稳定性较高的介孔4分子筛(4A)作为固载型POM的载体. 为提高分子筛的化学稳定性和抗酸碱能力,采用偶联剂对4A进行化学修饰. 将Keggin结构的磷钼酸铁(iron phosphomolybdate,FePMo12)负载于修饰后的载体上制备FePMo12/APTES-4A催化剂,将其填充于电化学反应器中,研究催化剂强化电化学氧化法降解染料废水的处理效果,考察各因素对体系脱色效果的影响.
1 材料与方法
1.1 实验材料
酸性大红3R,分子式:C20HllN2 O10S3 ·3Na,工业纯,天津一商化工贸易有限公司染料分公司生产; 3-氨丙基三乙氧基硅烷(APTES),分子式:H2NCH2CH2CH2 Si(OC2H5)3,分析纯,上海楷洋生物技术有限公司; 4Å分子筛(4A),有效孔径为0.4 nm,天津市永大化学试剂有限公司; 磷钼酸(H3PMo12O40 ·xH2 O,PMo12),分析纯,天津市大茂化学试剂厂; H2 SO4,分析纯,石家庄华迪化工工贸有限公司; NaOH,分析纯,天津市永大化学试剂有限公司.
1.2 FePMo12/APTES-4A催化剂的制备
称取11.3 g磷钼酸,溶于90℃的50 mL热水中,搅拌条件下,加入2.02 g溶于少量热水的硝酸铁,20 g溶于20 mL热水的乙酸钾,混合物90℃维持2 min,过滤,冷却到60℃,搅拌条件下加等体积甲醇,5℃放置24 h,析出的晶体用最少量的热水重结晶3次,55℃干燥,得FePMo12备用.
取50 g预处理后的4A分散在50 mL甲苯中,再加入3 mL的APTES; 将此混合溶液回流且室温搅拌12 h,倒出液体,分子筛25℃干燥,即得到经过APTES修饰的载体分子筛APTES-4A; 取上述4A 50 g分散在15 mL一定浓度的FePMo12水溶液中,控制溶液pH值在6~7之间,室温下搅拌24 h,用80℃的蒸馏水洗涤数次,室温下干燥,即得到负载型多金属氧酸盐杂化催化剂FePMo12/APTES-4A.
1.3 实验装置
电-多相催化氧化反应装置,主要由聚乙烯板制成的外壳、 阴极石墨板,阳极DSA电极(两极板间距可调),催化粒子FePMo12/APTES-4A组成. 电源电压可调范围为0~40 V,电流可调范围为0~10 A,反应器底部设有曝气孔.
1.4 实验方法
用1 mol ·L-1的H2 SO4和NaOH来调节酸性大红3R的初始pH值. 向反应槽内加入50 g催化剂FePMo12/APTES-4A和250 mL浓度为500 mg ·L-1的模拟酸性大红3R染料废水,调节电压和电流,接通电源,打开曝气装置控制曝气流量. 每隔一定时间取槽内溶液进行分析. 实验前将床体填料在模拟染料废水中浸泡吸附至饱和,以消除填充粒子吸附作用对脱色效果的影响.
1.5 分析方法
1.5.1 催化剂的表征
采用KBr压片,Nicolet6700/FT-Raman modules红外光谱分析仪在500~4000 cm-1范围内测定透光率. 日本Rigaku-D/Max-2500型X-射线粉末衍射仪测定,Cu靶,步长0.02,管电压40 kV,管电流100 mA,2θ测定范围: 0.5°~100°.
1.5.2 水样分析
模拟的染料废水pH采用雷磁pHS-3C pH计测定; 吸光度采用Vis-7220型可见-紫外分光光度计测定. 用UV2600在400~700 nm波长下对酸性大红3R的吸光度进行光谱扫描,确定酸性大红3R的最大吸收波长为507 nm,再用分光光度计测定此波长下的吸光度. 试样脱色率(DC)的计算公式[9]为:
DC=(A0-A)/A0 ×100% (1)
式中,A0为反应前试样的吸光度; A是电催化反应时间为t时试样的吸光度.
2 结果与讨论
2.1 催化剂的表征
2.1.1 红外光谱表征
标准Keggin结构PMo12有4个较为明显的特征吸收峰:Vas(P—O):1067cm-1、 Vas(Mo O):963.97 cm-1、 Vas(Mo—Ob—Mo):870 cm-1、 Vas(Mo—Oc—Mo):810~785 cm-1.图 1为实验室制备的FePMo12红外光谱图. 分析可知,自制FePMo12中的P—O键振动峰由1067 cm-1红移至1030 cm-1、 Mo—Ob—Mo键由870 cm-1蓝移至896 cm-1、 Mo—Oc—Mo键也蓝移至842 cm-1,Mo O断开,与Fe形成化学键,即形成Mo—O—Fe键,振动峰变弱,所以自制FePMo12仍具有Keggin结构.

图 1 FePMo12的红外光谱图
2.1.2 X-射线衍射表征
通过X-射线衍射可以定性地判断杂多酸的结构类型. Keggin型杂多酸阴离子的3个特征峰出现在7°~10°、 16°~22°、 25°~30°范围处. 图 2(a)为空白样品的X-射线衍射谱,图 2(b)为FePMo12/APTES-4A的X-射线衍射谱. 分析可知,在9.7°、 20.3°、 29.0°处分别出现3个特征峰,恰符合Keggin结构特征衍射峰特性,因此负载后的杂多酸较好地保留了Keggin形态.
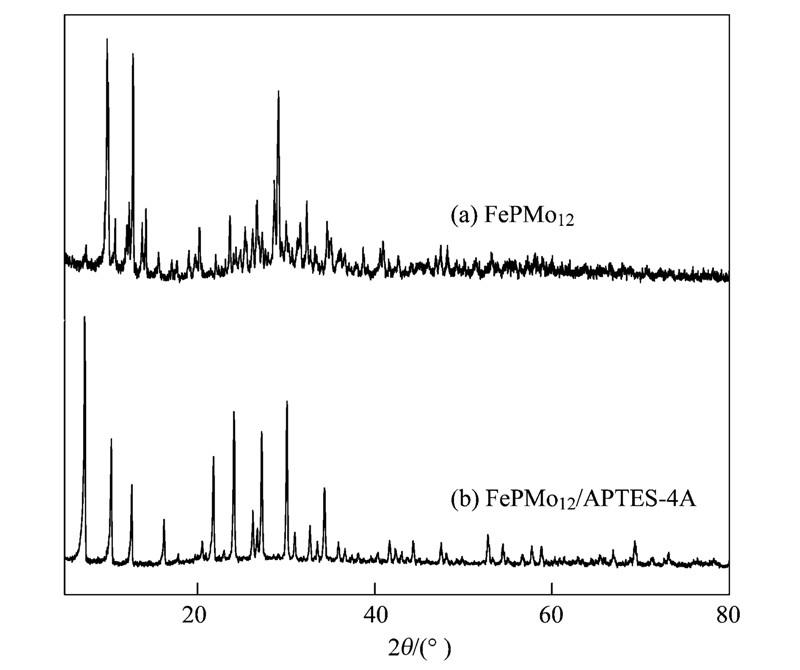
图 2 FePMo12/APTES-4A的XRD图谱
2.2 体系中各因素对酸性大红3R脱色的影响
2.2.1 FePMo12负载量的影响
FePMo12负载量对电催化效果的影响如图 3所示. 考察了电解时间为60 min时,活性组分负载量对脱色效果的影响. 从中可以看出无FePMo12负载时,色度去除率最低,说明活性组分FePMo12在电化学体系中起到了催化降解有机污染物的作用. 负载量为3%的催化剂,色度去除率最高. 负载量较低的时候,催化剂的活性组分较少,催化性能较弱; 当负载量超过3%时,影响FePMo12在4A内的分散度,降低催化活性[10]. 因此,选择活性组分负载量为3%的催化剂进行实验.
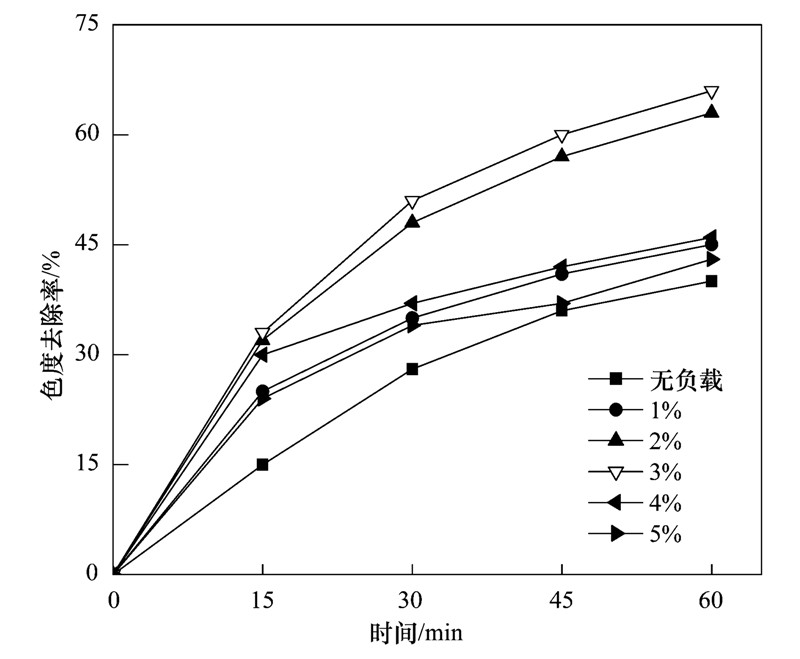
图 3 FePMo12负载量对电催化效果的影响
2.2.2 电解时间的影响
电解时间决定了氧化还原等作用时间的长短,时间越长,氧化还原等作用也进行得越彻底[10]. 由图 4可以看出电解时间越长,脱色效果越好. 随着氧化时间的延长,在90 min前,脱色率增长较快; 90 min后,脱色率增长不明显. 在反应初始的一段时间内体系中酸性大红3R溶液浓度较高,有机物大分子在外加电压的作用下迅速扩散到电极和催化剂表面并发生反应,所以在反应的初始阶段,脱色率随反应时间延长而增大; 当酸性大红3R溶液浓度变低时,单位时间内扩散到电极表面的酸性大红3R减少,所以随着电解时间的延长曲线趋于平缓. 确定电解时间为90 min.

图 4 电解时间对体系色度去除效果的影响
2.2.3 槽电压的影响
在电解反应中,外加电压是电解反应的动力源,外加电压直接影响染料废水的脱色效果[11]. 槽电压对酸性大红3R的脱色效果的影响如图 5所示. 当槽电压从16 V增加到22 V时,色度去除率从38.1%提高到72.1%; 随着槽电压的继续增大,脱色率却有所降低. 在电催化体系中,电极表面电位和FePMo12/APTES-4A的电极电位与目标污染物的电位差是电催化反应的推动力,电位差越大,电催化反应越彻底; 可是,随着外加电压的增加,阳极析氧副反应明显增加,副反应产生的氧气,吸附在电极表面,形成小气泡,不但阻碍了电极表面对有机物的吸附降解,而且影响羟基自由基产生,进而影响了有机物的去除率; 过高的电压会增加电催化反应的能耗[12,13]. 因此,选择22 V为最适槽电压.

图 5 槽电压对体系色度去除率的影响
2.2.4 初始pH值对电催化效果的影响
体系中pH值是影响电催化效果的重要因素之一,溶液pH值的改变将使电极表面的电荷以及氧化还原电位发生变化. 初始pH值对电催化效果的影响如图 6所示. 酸性条件下的脱色率优于碱性条件. 当染料废水的初始pH值为4时,色度去除率达到最大值. 多金属氧酸盐在不同pH的溶液中,能逐级分解成为一个或多个电子受体的杂多蓝,不同结构的杂多蓝对有机物的去除率效果不同. 当体系处于中性和碱性条件下,脱色效果不显著,这是因为Keggin型杂多蓝在溶液中没有发生质子化. PMo12O3-40的还原电位依赖pH值,随着pH的降低氧化还原电位正移,当pH值为4时,此时PMo12O3-40的杂多蓝发生高效的氧化还原反应,使得色度去除率达到最大值. 在酸性条件下,Fe3+亦可能发生类Fenton反应,提高脱色效果. 但是在强酸下电极基体很容易钝化,从而使其催化性能下降,影响阳极电极的寿命[14,15]. 所以,确定最适pH值为4.
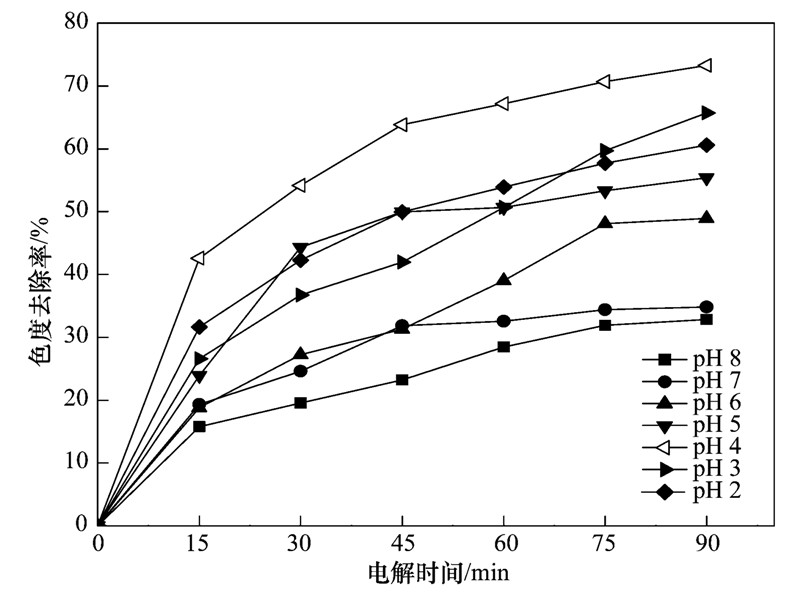
图 6 初始pH值对体系色度去除率的影响
2.2.5 曝气量对电催化效果的影响
图 7为曝气量对电催化效果的影响. 可以看出,随着曝气量的逐渐增大,色度的去除率也逐渐增加; 当曝气量大于0.08m3 ·h-1时,色度去除率出现下降趋势. 当曝气量逐渐增加时,溶解氧在阴极表面发生间接氧化反应,方程式如下:
O2+2H++2e-→H2 O2 (2)
生成H2 O2有利于有机物的氧化降解过程,加速有机物矿化[16,17]; 并且PMo12中具有的最高氧化态配位原子Mo,其还原态可被分子态O2可逆地氧化到氧化态并保持结构骨架不变,强化了催化剂氧化还原能力. 当曝气量过大时,目标污染物来不及与活性位点反应,不利于污染物的氧化. 所以,最佳曝气量为0.08m3 ·h-1.

图 7 曝气量对体系色度去除率的影响
2.2.6 极板间距对电催化效果的影响
极板间距对电催化效果的影响如图 8所示. 当极板间距从2.0 cm增加到3.0 cm时,色度去除率升高,当极板间距为3.0 cm时,色度去除率达到最大值75.3%. 当极板间距增加到3.5 cm和4.0 cm时,色度去除率则出现下降现象. 极板间距过大,反应体系的电阻随之增大,随着极板间距减小,相应缩短了对流、 扩散传质的距离,增大了传质的浓度梯度,强化了传质效果. 但间距过小会使体系温度过高,加剧副反应[18,19]. 因此,选择最适的极板间距为3.0 cm.
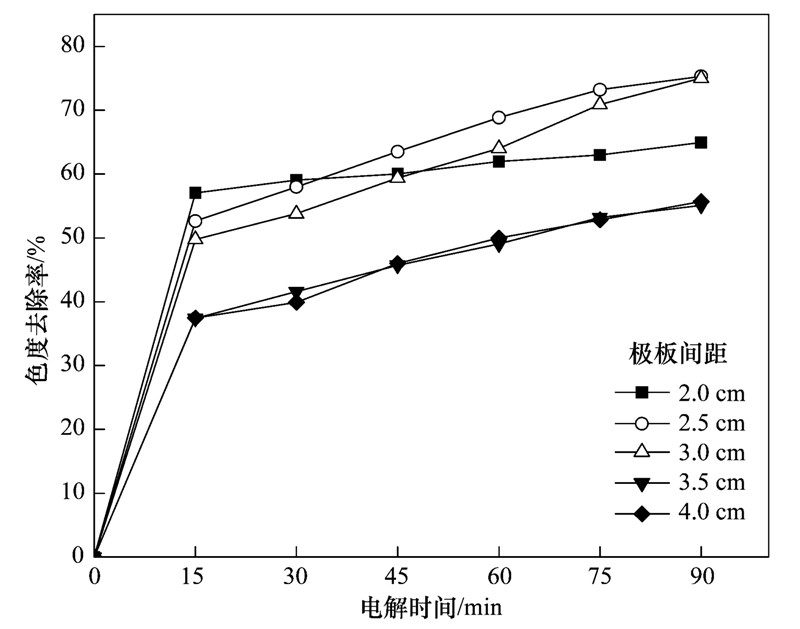
图 8 极板间距对体系色度去除率的影响
2.2.7 支持电解质对电催化效果的影响
电化学体系中加入支持电解质可以提高溶液的导电性,促进电子的转移,进而提高色度去除率[20, 21, 22]. 图 9为不同支持电解质浓度对酸性大红3R染料电催化效果的影响. 从中可以看出,色度去除率随着两种支持电解质NaCl和Na2SO4浓度的增大而先提高后降低. 当NaCl为支持电解质,NaCl浓度从0.01mol ·L-1增加到0.04mol ·L-1时,色度去除率从74.6%增加到90.5%. 当NaCl浓度为0.05mol ·L-1时,色度去除率达到最大为95.3%; 当NaCl浓度大于0.05mol ·L-1时,色度去除率出现下降趋势. 在Na2SO4为支持电解质时,Na2SO4浓度为0.04mol ·L-1时色度去除率达到最大为42.5%,当Na2SO4浓度大于0.04mol ·L-1时,色度去除率出现下降趋势.
支持电解质NaCl和Na2SO4对电催化效果的影响差别很大,用NaCl为支持电解质时的色度去除率明显高于用Na2SO4作为支持电解质的色度去除率,主要是NaCl为支持电解质时,体系中生成HOCl加速酸性大红3R的降解,提高脱色率.
阳极上发生电化学反应:
2Cl-→Cl2+2e- (3)
阴极发生的电化学反应:
2H2 O+2e-→H2+2OH- (4)
体系中发生的电化学反应:
Cl2+H2 O→HOCl+H++Cl- (5)
以Na2SO4为支持电解质时,SO2-4在体系中形成负盐效应,随着Na2SO4浓度增加,增加了电荷的屏蔽作用,降低了Fe3+和PMo12O3-40在溶液中的活度,所以色度去除率显著低于以NaCl 为支持电解质时的电催化体系[23, 24, 25].
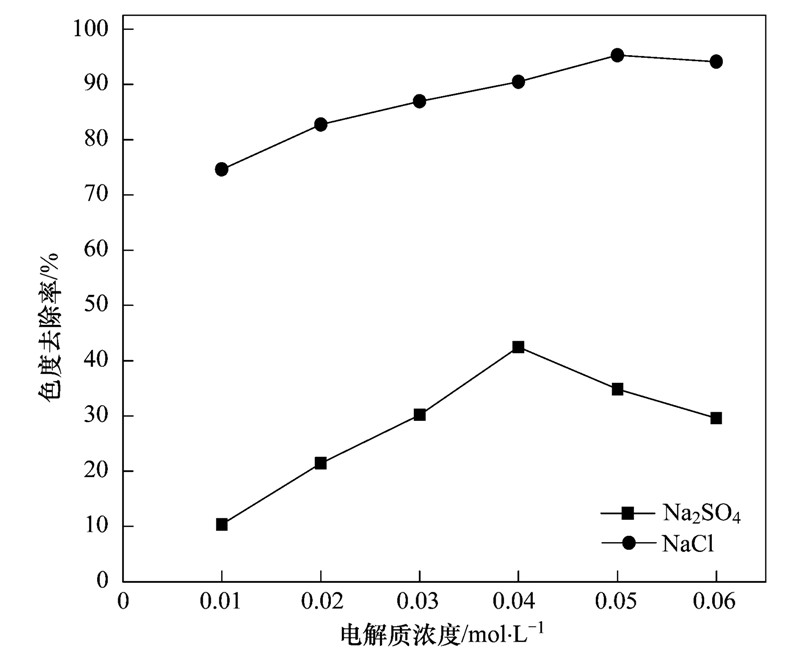
图 9 电解质浓度对色度去除率的影响
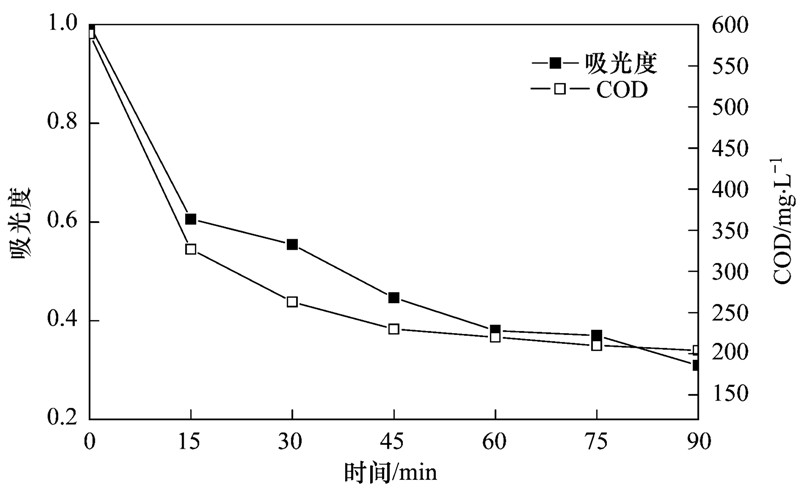
图 10 507 nm下吸光度和COD的降解曲线
2.3 紫外-可见光谱分析
在最优条件下考察电化学氧化体系对水样COD的降解效果. 图 10为不同时间507 nm下吸光度和COD降解曲线. 从中可以看出,当DC达到75.3%时,COD从589 mg ·L-1降至204 mg ·L-1,90 min时去除率达到65.4%. 表明随着氧化还原反应的不断进行,酸性大红3R逐渐被降解.
分析不同时间下的紫外-可见光谱曲线,由图 11可以看出,200~360 nm处的吸收峰是萘环或杂环不饱和体系所引起的; 507 nm处是酸性大红3R的特征吸收峰,该处的吸收峰是由显色—N N—基团和萘环共轭体所引起的. 随着氧化还原反应的不断进行,200~360 nm波段的吸收峰在30 min内高于初始值,可能是形成芳香胺类化合物等中间产物,而后随着电解时间的增加逐渐降低; 507 nm处的吸收峰逐渐减弱,表明—N N—被断开,使得脱色率不断增加[13]. 此外,光谱中并未有其他吸收峰出现,表明酸性大红3R降解90 min后没有转化为其他的大分子物质,而是有可能将其矿化为H2 O和CO2或小分子物质. 对比TOC变化曲线可以发现,TOC在30 min内降解较缓慢,主要发生的是显色基团的断链反应,生成芳香胺类化合物等中间产物; 而后随着时间延长TOC 的去除率不断增加,部分有机物发生了矿化,90 min后达到46.0%.

图 11 不同时间可见-紫外吸收光谱曲线和TOC变化曲线
3 结论
(1)采用IR,XRD方法对实验室自制的杂多酸FePMo12进行表征,结果表明合成的杂多酸具有较好的Keggin结构.
(2)FePMo12/APTES-4A催化剂对酸性大红3R模拟废水有良好的脱色效果,催化粒子填充量为50 g,负载量为3%,电解时间为90 min时,在pH为4,槽电压为22 V,曝气量为0.08 m3 ·h-1,极板间距3.0 cm反应条件下,90 min后脱色率达到75.3%,COD和TOC去除率分别达到65.4%和46.0%. 并通过可见-紫外光谱对酸性大红3R的中间产物分析,降解90 min后显色基团已基本被破坏.
(3)支持电解质NaCl和Na2SO4对电催化效果的影响差别较大,NaCl浓度为0.05mol ·L-1时,色度去除率达到最大为95.3%; 在Na2SO4为支持电解质时,Na2SO4浓度为0.04mol ·L-1时色度去除率达到最大为42.5%.(来源及作者:河北科技大学环境科学与工程学院 王栗、岳琳、郭建博、杨景亮、廉静、罗晓、王开红)
资讯